ISSN 1009-3079 CN 14-1260/R 世界华人消化杂志 2005年10月28日;13(20):2459-2463
Toll样受体及其在病毒性肝炎发病机制中的作用
赵甫涛, 姬新颖, 潘 蕾, 贾战生
赵甫涛, 姬新颖, 潘蕾, 贾战生, 第四军医大学唐都医院全军感染病诊疗中心 陕西省西安市 710038
国家自然科学基金资助项目, No.30570086
通讯作者: 贾战生, 710038, 陕西省西安市, 第四军医大学唐都医院全军感染病诊疗中心. [email protected]
电话: 029-83377853 传真: 029-83537377
收稿日期: 2005-09-28 接受日期: 2005-09-30
摘要
先天性免疫系统发挥防御作用的关键是对病原体的识别, 这一识别主要由Toll样受体(Toll-like receptors, TLRs)完成. TLRs通过识别病原微生物及其特殊结构, 介导宿主相关细胞因子的分泌和天然免疫应答的产生. 病毒基因组具有一些哺乳动物基因组所没有的特性物质, 比如高CpG含量和dsRNA等. 这些基因组核酸起着同病毒感染相关的分子信号的作用. 近年研究显示, TLRs在病毒性肝炎的发病机制中通过诱导TNF、IFN等的生成和调节Th1和Th2反应平衡而产生免疫刺激并发挥抗病毒作用. 因此, 对TLRs的认识和深入研究将为新型肝炎疫苗和免疫调节剂的研制提供新的重要理论依据, 并为病毒性肝炎的预防和治疗提供新的思路和手段.
赵甫涛, 姬新颖, 潘蕾, 贾战生. Toll样受体及其在病毒性肝炎发病机制中的作用. 世界华人消化杂志 2005;13(20):2459-2463
http://www.wjgnet.com/1009-3079/13/2459.asp
0 引言
Toll样受体(Toll-like receptors, TLRs)是近年来发现的在宿主抗病原微生物的免疫应答中起重要作用的细胞表面受体分子. 它们不仅在天然免疫应答中识别病原微生物的病原相关分子模式、激活先天性免疫应答, 还引起细胞因子的释放, 上调共刺激分子的表达, 为获得性免疫的启动提供必要的活化信号. 宿主通过这些受体感知病原微生物并直接做出防御反应, 不同的TLRs执行特定的抗肝炎病毒生物学效应[1,2].
1 TLRs家族的成员、结构特点和分布表达
Toll蛋白最早是1996年Lemaitre et al[3]在研究果蝇胚胎发育过程中发现的, 称为dToll, 随后发现它在介导成年果蝇天然免疫反应过程中起重要作用. 1997年, Medzhitov et al[4]首次在人体分离出果蝇Toll的同系物, 先称为人类Toll蛋白, 后命名为TLR4. 迄今, 已在哺乳动物中发现了11种TLR, 称为TLRs家族, 并分别命名为TLR1-11[5-9].
TLRs结构与dToll受体存在同源性, 由胞外区、跨膜段和胞内区组成, 属Ⅰ型跨膜蛋白受体. 其胞外区有550-980个氨基酸, 存在18-31个氨基酸的富含亮氨酸的重复序列(leucine-rich repeats, LRRs). LRRs中亮氨酸间隔分布于几个固定位点, 如此结构的LRRs利于促进蛋白质间的相互黏附, 可用来识别病原体或其产物. LRRs结构区的C端侧翼为富半胱氨酸区域, 与跨膜段连接. LRRs也参与控制配体对TLRs胞内负责信号传导结构区的激活. TLRs胞内区包括Toll同源结构域(Toll homology domain, TH domain)和分子羧基端长短不同的短尾肽(一般有0-22个氨基酸). TH domain有至少128个氨基酸, 结构较保守, 该序列与IL-1受体的胞内区有高度同源性, 又被称为Toll/IL-1受体(Toll/IL-1 receptor, TIR)同源区, 它是TLRs和IL-1R向下游进行信号传导的核心元件. 在TIR中有23个氨基酸位置是固定的(图1), 所形成的三个区域分别为其编码蛋白的标志区域和信号介导区域[10,11].
TLRs广泛分布于各种组织中, 且有细胞分布特异性. TLR1, 6, 9广泛分布于各类免疫细胞, TLR2, 4, 5分布于除T、B、NK外的免疫细胞, TLR3只特异分布于树突状细胞(DC)[12], TLR7, 8分布于外周血白细胞. TLR1, 2, 4, 5, 6均表达于细胞表面[13-16], TLR7, 8均来源于X性染色体, 结构高度保守, TLR3, 7, 8, 9存在于酸性胞内体(如endosome)[17-22].
图1
TIR结构示意图.
2 TLRs配体的特异性
Medzhitov和Janeway[23]将天然免疫细胞所识别的主要靶分子称为病原相关的分子模式(pathogen-associated molecular patterns, PAMPs), 将与之相对应的识别受体称为模式识别受体(pattern recognition receptor, PRRs). PAMPs均可被宿主作为外来分子进行识别, 且能激发宿主细胞因子如IL-1、TNF-α等及其他活性分子的合成, 对感染具有十分重要的作用. PRRs在先天性免疫中居于重要地位, 宿主能通过它们区别病原体与自我组织. TLRs即是一类PRRs, 通过识别不同病原体的PAMPs在抗感染天然免疫中发挥重要作用[24].
不同TLRs胞外区氨基酸组成的差异决定了各自有其特征性的配体. 目前已经明确: TLR1识别膜孔蛋白、PGN、糖脂和非典型LPS等[25-27]; TLR2可识别大部分现已发现的PAMPs结构, 如G+菌的PGN、分枝杆菌和疏密螺旋体的脂蛋白、酵母菌和支原体的某些成分等[28-32]; TLR3识别病毒dsRNA和聚肌胞苷酸poly(I:C)[33]; TLR4主要识别LPS及具有保守类脂A结构的衍生物[34,35], 还识别活结核杆菌的某些成分及内源性配体热休克蛋白60, 70等[36,37]; TLR5识别鞭毛蛋白[38]; TLR6主要识别细菌的肽聚糖和脂肽[39]; TLR7, 8识别抗病毒化合物, 许多情况下识别相同配体ssRNA[40,41]; TLR9主要识别非甲基化CpG DNA[42]. 另外, TLR1和TLR6能与TLR2形成复合受体识别一些微生物成分[43]. 最近发现TLR11识别Profilin样分子[44].
3 TLRs介导的信号传导通路
TLRs识别配体后, 可通过髓样分化因子88(MyD88)依赖和非依赖两种信号传导途径, 激活NF-kB和MAPK, 引起多种细胞因子的释放, 上调APC细胞表面CD80、CD86等共刺激分子, 并最终激活特异性免疫系统[45,46].
在MyD88依赖性信号传导通路, MyD88起着关键作用[47], 其C端有一个TIR结构域, 与激活的IL-1/TLRs胞质区形成蛋白质复合体来参与信号传导; MyD88的N端具有一个与肿瘤坏死因子受体(TNFR)胞内区相关的死亡结构域(death domain, DD). 当MyD88的C端TIR区与IL-1R/TLRs的胞质区发生相互作用时, MyD88通过N端死亡区募集带有同源结构的下游信号分子IRAK(IL-1R associated kinase)的死亡区域, 并与其结合[48]. MyD88作用的靶物质已证实是IRAK4. IRAK4与IL-1R/TLRs和MyD88 N端形成的受体复合物结合后, 即自动磷酸化. IRAK4磷酸化后, 即从受体复合物中解离、释放出来, 促进肿瘤坏死因子相关因子6(TRAF6)的聚合和活化[49], 进一步激活NF-kB诱导激酶(NF-kB-inducing kinase, NIK), NIK引起NF-kB激酶抑制物(inhibitor of NF-kB kinases, IKKs)磷酸化并激活, IKKs继而作用于NF-kB复合物中的特异性抑制因子IkB, 使其两个丝氨酸位点磷酸化, 最终导致其泛素化而降解. 通常, NF-kB与其抑制蛋白IkB相结合, 以复合物形式存在于胞质中. IkB降解后, NF-kB得以释放、游离, 并转运到细胞核内, 其活性二聚体启动细胞因子(如TNF-a和IL-1, 6, 8, 12等)和辅助黏附分子CD80、CD86的基因转录, 诱导特异靶基因的表达, 从而激活特异性免疫系统[50-52].
4 TLRs在病毒性肝炎发生和发展机制中的作用
免疫因素在病毒性肝炎的发生和发展过程中起着重要作用, 在肝脏的先天性免疫反应中, 肝的淋巴细胞则具有举足轻重的作用. 病毒感染过程中, NK细胞释放IFN-γ, 诱导T细胞介导的免疫反应, 导致感染细胞发生凋亡; 细胞毒性T淋巴细胞激活Kupffer细胞, 产生TNF-α, 从而诱导肝细胞凋亡[53]. 近年研究证实, TLRs通过诱导IFN和TNF等细胞因子的合成及调节Th1和Th2的反应平衡等而产生免疫刺激并发挥抗病毒作用[54].
Isogawa et al[55]研究发现, 给HBV转基因鼠静脉注射TLR3, 4, 5, 7, 9特异性的配体, 能够于24 h内通过IFN-α/b依赖途径抑制HBV的复制. 在浆细胞样DC, TLR9识别病毒来源的DNA, TLR9对A/D型CpG DNA的识别导致IFN-α的诱导产生. 在动物模型中, CpG ODN发挥着有效的Th1样免疫增强剂的作用. Imiquimod和R-848是imidazoquinoline家族中相对低分子量的化合物, 在动物模型中显示其具有很强的抗病毒作用. Imiquimod的活性主要通过细胞因子IFN-α和IL-12等的诱导来调节, R-848是一个更有效的Imiquimod类似物[56]. Weeratna et al[57]应用HBsAg作为模型抗原在老鼠中进行了研究, 结果发现, CpG ODN作为疫苗佐剂能增强体液和细胞免疫应答, 其作用明显优于R-848. Cooper et al[58]研究也发现, 在进行预防性乙型肝炎疫苗Ⅰ、Ⅱ期临床试验的志愿者和HIV患者体内, CpG 7909有很好的耐受性和增强的免疫原性.
一些学者对HCV蛋白诱导的细胞内信号和促炎性细胞因子等进行了研究. Sun et al[59]研究发现病毒感染和TLR3配体可激活先天性免疫反应, NK细胞产生IFN-γ, 通过STAT1、IRF-1及p21cip1/waf1的活化而清除病毒感染的肝细胞. Matsumoto et al[60]研究表明, TLR3配体蛋白及其下游的信号分子均与IFN-a/b的产生有关. 此外, 有研究发现, 人TLR3的表达还提高了NF-kB活性, 在DC的不同分化阶段TLR3的表达不一样, 提示TLR3与DC功能的调节有关[61]. Li et al[62]报道, HCV NS3/4A丝氨酸蛋白酶可水解TRIF(Toll/IL-1 receptor domain-containing adaptor inducing IFN-b)的特定蛋白质, 分解的TRIF通过TLR3通路而抑制poly(I:C)活化的信号, 导致TLR3不能与活化IRF-3和NF-kB的激酶相结合, 从而导致病毒的持续感染. Duesberg et al[63]证实了HCV C蛋白的合成脂肽是通过TLR2和TLR4介导的信号通路来调节免疫细胞活化的. Dolganiuc et al[64]发现, HCV C与NS3蛋白经TLR2触发炎性细胞活化, 却无法活化TLR2或MyD88缺乏小鼠的巨噬细胞. C与NS3诱导IRAK活化、p38磷酸化、细胞外调节激酶和c-jun氨基端激酶(JNK), 并诱导AP-1活化. C与NS3蛋白诱导的NF-kB活化与IkBa磷酸化增多相关. TLR2介导的细胞活化依赖于C与NS3蛋白的构象和C蛋白aa2-122与NS3蛋白aa 1 450-1 643区域的必需序列. 而且, HCV C蛋白与TLR2在细胞内共区域化存在. 因此, HCV C与NS3蛋白是通过TLR2信号通路, 从而诱导人外周血单核细胞炎症性细胞因子的产生. 这些研究表明, TLR2, 3, 4均参与了HCV的识别和天然免疫反应的活化.
目前研究发现, 血液中病毒感染后发生免疫应答时, 浆细胞源性DC(pDC)是主要产生IFNs等抗病毒细胞因子的免疫细胞. Honda et al[65]研究证实, 病毒和TLR活化的MyD88依赖性信号传导通路中IFN-a/b的诱导产生都受IRF-7的调控. 在人和小鼠, 产生IFN的pDC的细胞表面表达TLR7和TLR9, pDC及B淋巴细胞通过TLR7识别ssRNA而激活协同刺激分子并产生细胞因子[66]. Gibson et al[67]研究表明, imiquimod和resiquimod诱导纯化的pDC产生IFN-a和IFN-w, 受resiquimod刺激的pDC还产生一些其他细胞因子, 如TNF-a和IP-10.
Lund et al[68]应用TLR7缺陷小鼠的研究显示ssRNA病毒通过TLR7刺激IFN-a/b应答, 同时通过MyD88缺陷小鼠的研究显示这种应答也依赖于MyD88. Akira et al[24]研究发现, 在MyD88敲除小鼠中, 对imidazoquinolines的免疫应答被完全阻断, 这提示TLRs与对imidazoquinolines的免疫应答有关. 进一步研究表明, 在抗病毒免疫反应中, MyD88缺陷小鼠的腹腔巨噬细胞不能合成TNF或IL-12等细胞因子. TLR7缺陷小鼠的巨噬细胞对Imiquimod或R-848没有应答, 对其它TLRs调节剂却有应答. 这些结果表明, TLRs参与了抗病毒免疫反应, 且TLR7对imidazoquinolines的应答是必不可少的[69]. 此外, 这些调节剂还可诱导B细胞扩增及DC表达CD80、CD86, 而TLR7基因敲除小鼠细胞的这两种作用都明显减弱, 同时INF-a、TNF和IL-12的表达也减弱[70]. 因此, 有国外学者[71]认为TLR7是一个新的病毒感染感受器.
总之, TLRs的活化提供了一种治疗HBV和HCV感染的新策略, 靶向TLRs的信号途径可能是治疗肝炎病毒感染的新途径. 随着研究的不断深入, 相信还会有更多的令人惊奇和鼓舞的新发现.
5 问题与展望
TLRs是近年才发现的第一个通过感知微生物病原体而直接做出防御反应的介导天然免疫反应的古老受体家族, 是宿主非特异性免疫的主要受体, 它的发现和深入研究有助于进一步揭示与肝炎病毒感染有关的免疫现象. 自从TLRs发现以来, 该领域的研究取得了长足的进步, 但是仍有许多问题尚待解决, 如: TLRs与配体结合的机制; 这些受体之间的相互作用如何; 是否还存在其他感受受体和配体, 尤其是TLR7, 8的天然配体; 以及在信号传导方面, 不同的TLR如何诱导特异性的信号通路调节不同基因的表达以介导不同的生物学效应等. 同时, 研究表明, TLRs的过激活也会导致免疫紊乱甚至自身免疫性疾病的发生, 因此, 如何调控TLRs的表达也是一个值得研究的重大课题.
随着对TLRs研究的不断深入, 上述问题将逐步得以阐明, 也将极大地拓展我们对病原体与宿主免疫反应之间相互作用复杂性的认识, 还有助于我们了解宿主抗肝炎病毒免疫反应的机制, 并为临床治疗奠定基础. 而且, 由于基因研究可阐明人TLRs基因的突变能否增加对病毒感染的敏感性, 因此, 研制作用于TLRs的疫苗可辅助刺激非特异性免疫, 进而加强特异性免疫. 此外, 针对TLRs为靶点的药物研究也正成为一个热点, 对TLRs信号通路中某些环节的干预将可能成为一种免疫治疗新策略, 并有可能为提高病毒性肝病的疗效带来希望.
由此, 阻断TLRs的功能是一个潜在的治疗选择, 可通过三种手段实现: (1)发展特异的结合并中和外源或内源配体的可溶性TLRs分子; (2)发展干预TLRs细胞内位点的小分子物质, 在配体与TLRs结合后, 防止细胞内信号分子与微生物的相互作用; (3)发展干扰TLRs的细胞外位点的小分子物质或抗体, 阻止配体与细胞表面的TLRs位点结合. 如果TLRs的配体结合物的准确性和特异性足够高, 这将是最有效的治疗方法. 因此, TLRs的认识和深入研究将为新型肝炎疫苗和免疫调节剂的研制提供新的重要理论依据, 并在很大程度上影响严重病毒性肝病的预后. 有理由相信, 加强对TLRs的研究将会为病毒性肝炎预防和治疗的基础研究和临床应用开辟广阔的前景. 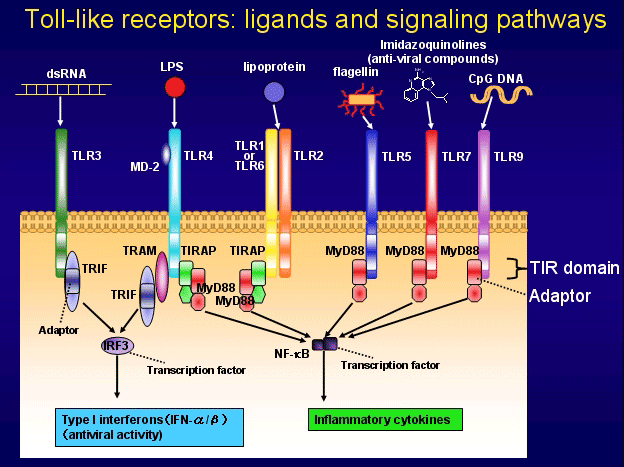

[此贴子已经被作者于2007-7-19 13:09:22编辑过]
|